7月19日,由默克雪兰诺公司主办的“亚太肿瘤峰会暨NECTAR(Network of CRC MDT in AP Region)峰会”在韩国首尔召开。来自多个国家、专注于结直肠癌诊治的肿瘤学专家,齐聚一堂,共同探讨关于结直肠癌患者治疗的研究热点,交流彼此的临床实践经验。其中,来自德国奥登堡大学医学院肿瘤中心的克洛-亨宁·克内(Clause-Henning Kohne)教授、法国维勒瑞夫保罗布劳恩斯医院的勒内·亚当(Rene Adam)教授、美国南加州大学诺里斯综合癌症中心的海因茨-约瑟夫·伦茨(Heinz-Josef·Lenz)教授分别从外科学专家视角、欧洲临床实践分析以及靶向药物治疗方面,进行了讲座,并回答了参会专家提出的问题;世界各国的专家也在随后的专题研究会上,对不同治疗方案提出了各自的见解。同时,全国各地区医院的肿瘤科医生借此良机,共同分享了靶向药物的治疗经验。
ESMO共识指南解析
讲者:克洛-亨宁·克内(Clause-Henning Kohne)教授
患者分组及治疗方案推荐
欧洲肿瘤内科学会(ESMO)将转移性结直肠癌(mCRC)患者进行了分组。对组1(存在潜在可切除转移灶)患者,需要高反应率的治疗方案。
2013年美国临床肿瘤学会(ASCO)年会更新的CELIM 研究结果显示,对KRAS基因野生型、具有不可切除局限性肝转移的患者,接受西妥昔单抗+化疗较单纯化疗,达到完全切除(R0)的患者的中位总生存(OS)为53.9个月对21.9个月。上海复旦大学附属中山医院许剑民教授等发表在《临床肿瘤学杂志》[J Clin Oncol, 2013,31(16):1931]的随机对照研究同样显示,对KRAS基因野生型患者,与单纯化疗相比,西妥昔单抗联合化疗组患者的客观有效率(ORR)为57.1%对29.4%,R0切除率为25.7%对7.4%,R0切除患者与未切除患者的中位OS为46.4个月对25.7个月。
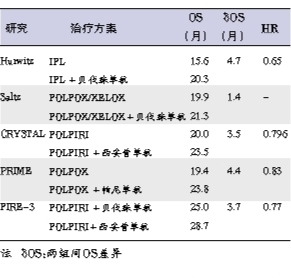
对于组2、组3的KRAS基因野生型mCRC患者,2012年ESMO指南强烈推荐一线治疗方案有西妥昔单抗+FOLFIRI、帕尼单抗+FOLFOX、贝伐珠单抗+FOLFOX/XELOX。
FIRE-3研究解析
2013年ASCO年会首次报道的FIRE-3研究,头对头比较了西妥昔单抗+FOLFIRI和贝伐珠单抗+FOLFIRI方案的疗效。虽然在意向治疗人群(ITT),主要研究终点ORR和次要观察终点之一的无进展生存(PFS)未有统计学差异,但是,在ITT中,次要观察终点OS有显著差异(28.7个月对25个月,HR=0.77,P=0.017)。这里着重对FIRE-3研究存在的疑问进行解析。
“FIRE-3 主要研究终点(ORR)未达到,是阴性结果?” 这种说法否定了3.7个月OS获益的临床意义。OS是临床研究中最为重要、可信的研究终点,因为OS 获益很难到达,所以临床研究中才会考虑使用替代终点。
“OS获益主要由二线或后线治疗决定,而非一线治疗决定?” 2013年,世界胃肠道肿瘤大会(WCGIC)报道了该研究的二线治疗结果。西妥昔单抗和贝伐珠单抗组接受二线治疗的比例分别为78.5%和76.4%,其中接受奥沙利铂和伊立替康的比例为63.7%对62.8%和15.7%对15.7%;交叉到西妥昔单抗和贝伐珠单抗的比例为46.6%对41.4%;继续使用西妥昔单抗和贝伐珠单抗的比例为15.2%对17.3%,研究者认为两组二线治疗相当(图1)。
纵观针对晚期结直肠癌的一、二、三线治疗的随机对照研究,其中一线治疗患者PFS约9~12个月,二线治疗患者PFS约4~7个月,三线治疗以后研究患者PFS约2~4个月。因此,一线治疗对于OS的贡献最大,更何况是3.7个月的OS差异。
“研究中FOLFIRI+贝伐珠单抗组表现较弱,不能代表其真实疗效?” 对比TRIBE、TML、SKK41/06研究,不难发现FOLFIRI或其他标准化疗方案联合贝伐珠单抗治疗,患者中位OS分别为25.8个月、23.9个月、24.9个月,与FIRE-3研究中25个月相当,基本反映了贝伐珠单抗的疗效。
“3.7个月的中位OS差异和HR=0.77,获益不足以改变临床实践?” 参考一线靶向药物联合标准化疗临床研究,例如AF2107g(联合IFL)、NO.16966、CRYSTAL和PRIME研究,可以发现,OS差异分别为4.7个月(IFL)、1.4个月、3.5个月和4.4个月;HR分别为0.65、无显著差异、0.796和0.83,可见3.7个月的中位OS差异和HR 0.77的临床意义应该很大(表1)。
“FIRE-3研究样本量为597例,需要等待更大样本量的CALGB研究结果?” 目前,一线治疗完成和进行中的头对头研究有4个:FIRE-3研究、PEAK研究、GALGB研究和SPIRITT(二线)研究。
PEAK研究结果与FIRE-3 研究结果非常相似,患者PFS没有差异(帕尼单抗组10.9个月对贝伐珠单抗组10.1个月),但OS在贝伐珠单抗组为25.4个月,帕尼单抗组还未到中位值。
CALGB 研究的 样本量为1142例,化疗方案包括FOLFOX(70%)/FOLFIRI(30%),因此在联合FOLFIRI组样本量也是无法和FIRE-3相比的,只是增加了贝伐珠单抗+FOLFOX治疗的证据。
“贝伐珠单抗对于KRAS野生或突变都可适用,不必等待KRAS检测结果,决定治疗决策?” FIRE-3研究早期入组300例患者,其中100例KRAS基因突变患者,这部分患者疗效的研究分析发表在2012年《肿瘤学年鉴》(Ann Oncol),西妥昔单抗组和贝伐珠单抗组患者PFS分别为7.5个月对8.9个月,OS分别为22.7个月对 18.7个月。
2013年ASCO年会报道的ITACA研究显示,无论反应率(RR)、PFS、OS,联合贝伐珠单抗对比单纯化疗,都无获益。如果再考虑一线随机对照研究中,联合FOLFOX/XELOX的研究NO.16966,只有PFS获益,无OS 获益,目前没有一线Ⅲ期随机对照研究证实联合FOLFIRI的有效性。
TML研究是二线研究,非跨线研究,OS只有1.4个月获益(11.2个月对9.8个月),E3200研究中两组的OS分别为 12.9个月对10.8个月,因此临床实践中要先检测患者KRAS基因状态,再决定治疗决策。
“ESMO指南对于组3患者(无临床症状、无疾病进展)认为要应用低毒的治疗方案,而无症状的患者接受西妥昔单抗+化疗会经受由靶向药物引起的疾病以外的痛苦?” 在选择一线治疗方案时,要平衡治疗带来的风险因素及生存获益。IFL±化疗可应用在所有患者(IFL方案目前多被淘汰),在KRAS野生型患者中,可以应用FLOFIRI±西妥昔单抗、FOLFOX±帕尼单抗或FOLFOX±西妥昔单抗。
mCRC的靶向治疗
讲者:海因茨-约瑟夫·伦茨(Heinz-Josef·Lenz)教授
mCRC从治疗方案到治疗药物,都纷繁复杂,哪种为最佳一线治疗方案、应进行哪类RAS基因检测、肿瘤应答(DpR)是否能更好预测患者OS、靶向药物应用顺序是否影响延长OS,都需要进行深度讨论。
对KRAS基因指导表皮生长因子受体(EGFR)抗体的选择,PRIME研究(Ⅲ期临床研究,比较了FOLFOX±帕尼单抗一线治疗KRAS野生型mCRC患者的疗效)进行了深入的分析,全组患者OS有所提高,但未有统计学差异(HR=0.83,P=0.072)。深入分析KRAS野生型的患者中,还有12%的患者存在NRAS突变,这一亚组患者不能从帕尼单抗中获益。
抗体依赖的细胞毒作用(ADCC),是西妥昔单抗特异的效应途径。PRIME和CRYSTAL研究显示,二者在一线治疗有效性方面,效果较为一致。此外,IgG1特异活性只有西妥昔单抗中被观察到,可见补体依赖的细胞毒作用(CDC)和ADCC以及消耗EGFR都存在于西妥昔单抗的治疗反应中,而帕尼单抗只能单纯消耗EGFR,且西妥昔单抗在目前检测到的肿瘤和所有化疗方案中,均可以提高细胞毒作用。
DpR对OS影响较大而与PFS关系不大,CRYSTAL研究中,西妥昔单抗治疗组与单纯化疗组患者相比,OS差异为3.5个月,明显大于PFS差异(1.5个月),这得益于联合化疗组更强的DpR(50.9%对33.3%,P<0.0001)。
综上,西妥昔单抗可提高mCRC患者的RR、PFS和OS,可让更多患者获得R0切除机会;RAS基因检测可提高西妥昔单抗为基础的一线化疗有效性;DpR与患者OS密切相关;肿瘤生物学效应可能依赖血管内皮生长因子(VEGF)或EGFR抗体的使用顺序;一线化疗药物的选择会直接影响患者OS。
[6720401] (西子 整理)
多学科协作(MDT)在mCRC治疗中展望
讲者:勒内·亚当(Rene Adam)教授
促进mCRC患者OS提高 以往多项Ⅲ期临床研究结果都显示,接受靶向药物治疗的mCRC患者,其OS都能得到显著提高。但如何维持并促进这种显著的进展,则需要通过在一线治疗时选择有效的治疗方案、选择对靶向药物治疗有效的患者、对不同组别患者制定后续治疗方案以及采用MDT方式。
对于肝脏转移灶,只有20%的患者可以接受手术切除,获得治愈的机会;另外80%的患者中,有10%~30%初始不可切除的患者在接受转化性治疗后转变为可切除,余下70%~90%的患者仍然无法手术切除转移灶。
如何有效获得手术切除可能性 从外科医生角度来讲,获得手术切除可能性的重要条件包括合理的一线治疗方案、尽可能短的化疗时间以及专业的多学科综合治疗。
首先,手术切除转移灶要依赖于肿瘤反应率,有效的药物治疗可以提供最佳的手术机会,福尔普雷斯特(Folprecht)等研究显示,当反应率为70%左右时,转移灶的切除率为50%。CRYSTAL、OPUS及COIN研究中, KRAS基因野生型的患者,接受西妥昔单抗联合化疗的肿瘤反应率及R0切除率要显著高于单纯化疗的患者,且一线化疗方案同时也决定了后线治疗的方案选择。
其次,缩短化疗时间,对于准备进行手术切除转移灶的患者,可避免由于化疗产生的肝脏毒性(例如伊立替康所引起的脂肪性肝炎等);缩短化疗时间,还可以减少手术中的并发症。
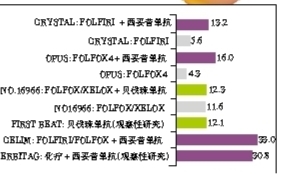
我们的研究显示,随着化疗周期的延长,患者在术后的死亡率也随之增高,化疗≥10个周期的患者,术后死亡率达60%。有研究表明,在接受术前化疗的患者,首次肝转移灶切除术后,化疗为1~6周期的患者,生存率显著高于>6周期的患者,且只接受一线治疗的患者,生存率较接受二线、三线治疗的患者显著增加。在CRYSTAL和OPUS研究中,化疗联合西妥昔单抗可以获得较快的肿瘤反应率,并与延长患者OS具有相关性(图1)。
此外,在mCRC患者的日常治疗中,需要多学科综合治疗方式。同是接受西妥昔单抗联合化疗的患者, CRYSTAL和OPUS研究中,由内科医生收治患者并决定手术切除的可能性,在获得较高反应率的情况下(71%和76%),患者的肝转移灶切除率为13%和16%;而CRLIM和POCHER研究中,由与肝脏外科医生联合的MDT团队收治患者并决定手术切除,在高反应率的情况下(70%和79%),患者的肝转移灶切除率为33%和60%。可见,若要获得最佳的治疗效果,肝脏外科医生一定要在治疗伊始便与肿瘤内科医生联合。
获得手术切除的机会十分重要 科佩茨(Kopetz)等研究显示,接受肝转移灶切除的患者,较未切除患者的中位OS及5年OS高(65.3个月对26.7个月;55.2%对19.5%);CELIM研究显示,在西妥昔单抗+FOLFIRI/FOLFOX的患者中,接受R0切除的患者较未接受R0切除的患者,PFS及OS显著延长(15.4个月对8.9个月;46.7%对27.3%);许剑民等研究也显示,西妥昔单抗+化疗较单纯化疗可显著提高患者的ORR、PFS、OS及切除率。
作为唯一能够延长患者长期生存的治疗方式,手术应该是mCRC患者治疗方案的重要的研究重点;同时,有效的一线治疗方案及较短的药物治疗时间可以使患者获得最佳的手术机会,同时减轻肝脏毒性,将治疗效果最大化;此外,专业的MDT团队,对于任何以治愈为目的的治疗和医生之间的相互交流都非常重要。


评论