病历摘要
患者,男,52岁,2011年12月因“进食梗阻感进行性加重2月”,入我院接受治疗。
辅助检查
2011年12月14日胃镜检查结果:距门齿28 cm处可见食管后壁有一不规则隆起,表面糜烂、充血、质硬脆易出血;活检病理为鳞状细胞癌。2011年12月20日食管钡餐检查示食管胸中段癌(图1)。2011年12月19日正电子发射体层摄影(PET)-CT检查结果:食管壁增厚伴软组织肿块形成,高代谢,考虑食管癌;右侧锁骨区、胃周、腹腔多发淋巴结肿大,高代谢,考虑肿瘤转移(图2)。.jpg)
诊断
根据第7版美国癌症联合委员会(AJCC)食管癌TNM分期以及2012、2013年《美国国立综合癌症网络(NCCN)食管癌临床实践指南》,临床诊断为食管胸中段鳞癌Ⅳ期(cT3N2M1,卡氏评分100分)。
治疗经过
经过多学科讨论,2011年12月25日至2012年1月29日患者在我院放疗科接受螺旋断层放疗(TOMO-therapy),放疗剂量和放射野的设计见讨论部分。放疗结束后2个月行食管钡餐随访示肿块阴影消失,黏膜皱襞恢复,扩张无异常,管壁柔软(图3)。放疗后2个月复查PET-CT示右侧锁骨区淋巴结及腹腔淋巴结糖代谢摄取量明显减少,无活性(图4)。患者放疗中出现Ⅰ级急性放射性食管损伤反应,放疗后随访1个月内出现Ⅰ级无症状急性放射性肺炎反应,无乏力、血细胞下降等副作用。
2012年4月,当地医院医生给予患者口服卡培他滨治疗,1 g/m2、2次/日,服2周停1周,共服用7个疗程;同时给予尼妥珠单抗治疗,200 mg/m2、每周1次,服3周停1周,共4个疗程。
2012年10月,患者开始出现右胸背部疼痛,与进食无关。胃镜提示食管癌放疗后改变,距门齿26~28 cm处可见黏膜溃疡形成。结合PET-CT结果诊断为食管癌食管穿孔(图5)。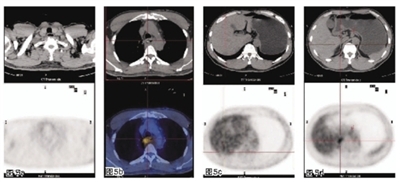
2012年11月1日,对患者行食管癌根治术。术中见主动脉弓后食管穿孔,周围有组织炎症增生。术后病理未见明确肿瘤残留,散在黏膜下腺体变性;两切缘未见肿瘤累及。检出食管旁淋巴结1枚,呈慢性炎症改变。免疫组化结果:角蛋白(CK)广为(-),高分子量细胞角蛋白(HCK)为(-),P63(-),Ki-67(-),平滑肌肌动蛋白(SMA)(平滑肌+),结蛋白(DES)(平滑肌+),CD68(组织细胞+),CD34(血管+)。放化疗疗效评价为病理学完全缓解(pCR)。
2013年6月8日术后随访PET-CT显示双锁骨区、食道吻合口、隆突下、胃小弯和胰头周围未见肿大淋巴结有肿瘤性糖代谢增高(图6)。随访至2013年9月,患者无明显不适。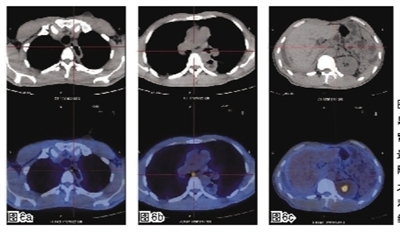
分析讨论
患者是否有放疗的指征?放疗的目的如何?
放疗的指征 患者为食管胸中段癌,同时伴有锁骨上区、胃周和腹腔等多处淋巴结转移,应归为远处转移,但仍处于区域性,外科医生不主张手术,对于Ⅳ期患者,主张同步放化疗。同步放化疗多推荐化疗以5-氟尿嘧啶(5-FU)为基本药物,结合放疗后的患者生存获益较单纯放疗更佳,这是基于放射治疗肿瘤学研究组(RTOG)的临床研究作为Ⅰ类证据的推荐。
因此,该患者有放化疗指征。
放疗的目的 对Ⅳ期食管癌行放化疗的目的,绝大部分是姑息性的,部分是术前新辅助放化疗性的。若放化疗后患者有机会接受手术,则应考虑根治性手术。
该患者在放疗10个月后因食管穿孔接受了原发灶根治性手术切除和区域淋巴结清扫术,手术病理证实达到pCR。因此,对于该病例,我们认为,初始放疗的目的是姑息性放疗,后转为术前放疗。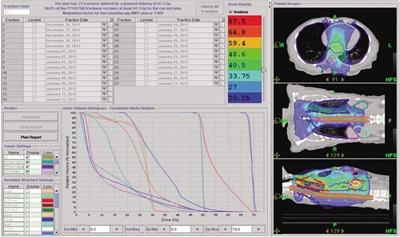
如何设计患者的放疗方案?
放射野设计 根据PET-CT的表现,患者为广泛性淋巴结转移,包括锁骨上、胃周、腹腔淋巴结。放射野的设计应考虑将食管肿瘤和可见的淋巴结作为大体肿瘤靶体积(GTV),而食管肿瘤的计划靶体积(PTV)必须是头脚端各扩5 cm,前后左右外扩1.5 cm,双锁骨上淋巴结引流区、纵隔、贲门旁、胃小弯、腹腔干旁淋巴结应该包括在内,作为临床靶体积(CTV),即从中下颈部纵隔至腹腔的淋巴结引流区域全在CTV范围内(图7、8)。
放射剂量选择 根据RTOG临床研究的结果,50.4 Gy和64.8 Gy的常规分割剂量对患者生存情况的影响无差别,但接受放疗剂量小者,放疗对其食管、肺和造血系统及胃肠道等的副作用小。目前NCCN指南推荐的方案是原发灶剂量为50.4 Gy/28次,并结合化疗。但是,目前对于腹腔和锁骨上淋巴结转移病灶的放疗剂量,尚无高级别的证据支持。
结合国内外的治疗经验,我们对该患者采用的是锁骨上淋巴结转移灶和食管癌原发灶GTV总放疗剂量(DT)为6750 cGy/27次,胃周淋巴结转移灶GTV DT为5940 cGy/27次,而后腹膜淋巴结转移灶的GTV DT为6480 cGy/27次,CTV(淋巴结引流区)DT为4860 cGy/27次。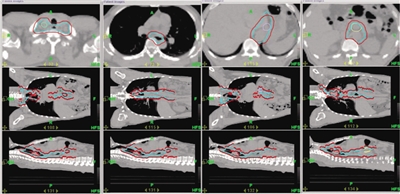
放疗技术选择 该患者的放射野须包括颈部、锁骨上、纵隔、腹腔和腹膜后淋巴结,即把食管癌及其所有淋巴结引流区都必须包括在内,长达44 cm。用C形臂直线加速器的三维适形放疗或调强放疗(IMRT),剂量分布不理想。若用两个中心则必须分野,势必出现热点或冷点。对腹部淋巴结,用三维适形放疗超过50 Gy,易出现胃损伤。我们采用螺旋断层放疗就可轻易地对所有可见淋巴结和食管肿瘤达到高剂量,而胃肠道、双肺、脊髓、心脏的受照剂量在可耐受范围内。食管癌放疗后80%失败是因局部或区域性(淋巴结)复发。由于螺旋断层放疗是新放疗技术,其虽能提高肿瘤放疗剂量,但能否减少局部肿瘤复发,值得进一步探讨。
放疗是否应结合其他治疗?
尼妥珠单抗可与EGFR特异性结合,阻断内源性配体介导的EGFR信号传导通路,从而抑制肿瘤的生长。研究表明其作用机理与西妥昔单抗相似。据Ⅰ、Ⅱ期研究报道,每周用西妥昔单抗和化疗药物紫杉醇、卡铂,结合50.4 Gy的常规放疗,Ⅲ度皮炎的发生率为23%,Ⅲ或Ⅳ级放射性食管炎的发生率为15%。国外大量文献报道指出,以5-氟尿嘧啶(5-FU)为基础的同步放化疗是目前局部晚期食管癌的标准治疗方案。该患者口服卡培他滨序贯化疗,同时接受了尼妥珠单抗靶向治疗。但尼妥珠单抗在食管癌放化疗中的疗效还待进一步确认。
放疗后穿孔并发症发生原因是什么?如何处理?
患者在放疗结束后9个月出现食管穿孔。这可能与肿瘤放疗剂量的增加、化疗药物和靶向药物的治疗有关。放疗结束后随着肿瘤的消退,瘤床未充分修复。由于同时应用了5-FU的前体药物(主要在上皮和肿瘤内转化为5-FU)和EGFR的分子靶向药物,导致上皮修复延迟,等效生物剂量超过食管的耐受量。这些是导致穿孔的主要原因。
既往对食管癌穿孔采用造瘘术或留置内支架,短期效果是可缓解患者的吞咽困难,但不能解决根本问题。若评估后可行手术治疗,则考虑手术。该患者经过放疗,放射野内食管病灶及转移的淋巴结得到控制,则可接受手术治疗,同时可借此评价放化疗疗效。由于食管肿瘤接受的放疗剂量较大,而肿瘤之外的正常食管接受照射剂量不大(见图8的剂量分布),可以避免放疗后手术出现食管瘘。
结语
该临床病例证实,对伴有锁骨上和腹腔淋巴结同时转移的中下段食管癌患者,是可进行术前放化疗的。
第6版AJCC食管癌分期明确指出,中胸段和下胸段食管癌出现的腹腔淋巴结或锁骨上淋巴结转移,均为非区域淋巴结转移,应归为远处转移(M)。无论其原发灶如何,皆不宜接受手术切除。哈根(Hagen)等报道,对不能接受手术切除的食管癌患者,通过三维适形放疗技术进行术前放化疗,之后行手术者的中位生存期较不接受手术者延长25.4个月(从24.0个月延至49.4个月)。接受术前放化疗患者的入选条件为T1N1M0或T2~3N0~1M0,无远处转移。显然,该患者不宜接受三维放疗技术的术前放化疗,这是由于自锁骨上淋巴结到腹腔淋巴结,长度往往超过40 cm(目前加速器的最大放射野≤40 cm),目前的直线加速器放疗技术很难完成。
随着放疗设备和技术的进步,用螺旋断层放疗(TOMO)技术,可以轻而易举地完成包括双锁骨上和腹腔淋巴结在内的食管癌放疗。该患者在放疗前未被定为术前放疗,故接受了超过术前放疗的剂量。后给予氟尿嘧啶类化疗及抗EGFR分子靶向药物治疗。放疗结束后9个月出现食管溃疡穿孔,给予了补救性手术切除,并最终成功获得食管癌根治性切除。
从此病例我们可以看到,用TOMO技术对伴有锁骨上和(或)腹腔淋巴结转移的非区域性淋巴结转移食管癌患者,可进行术前放化疗,但放疗剂量仍须遵循术前放疗所规定的剂量,即原发灶50.4 Gy/27次。对非区域性(手术难清扫)淋巴结转移灶必须给予根治性放疗剂量。这种治疗模式一旦成为标准治疗,食管癌的分期标准也许就会发生变化,即目前的非区域淋巴结转移被归到区域淋巴结转移。
因此,对于晚期食管癌患者,TOMO治疗+化疗+靶向治疗+手术获得了病理学完全缓解(pCR),实现了根治性治疗,生存明显获益。这为晚期食管癌的治疗提供了全新的治疗模式和方案的参考,但其治疗效果及放疗剂量仍有待进一步深入探讨。


评论